Synonyme: Sekundärelemente
veraltete Synonyme: Akkumulatoren (kurz: Akkus)
Begriffserklärung
Was landläufig als wieder aufladbare Batterie oder Akku bezeichnet wird, heißt streng genommen sekundäre Batterie oder Sekundärelement. Das ist die Bezeichnung für Vorrichtungen zur Speicherung von elektrischer Energie in Form von chemischer Energie, die als elektrische Energie entnommen werden kann. Im Gegensatz zu primären Batterien kann sie wieder aufgeladen werden. Dies erfolgt mit einem elektrischen Strom (siehe elektrischer Strom), welcher in entgegengesetzter Richtung zu dem Strom fließt, der beim Entladen entnommen wird. Das Aufladen funktioniert, weil sich die chemischen Reaktionen, die beim Entladen ablaufen, dabei nahezu vollständig rückgängig machen lassen.
Oft werden primäre und sekundäre Batterien kurz als Batterien bezeichnet, weil aus dem Kontext oder dem Batterietypen erkennbar ist, welche Art gemeint ist. So sind derzeit alle kommerziell erhältlichen Redox-Flow-Batterien oder Starter-Batterien in Kraftfahrzeugen sekundäre Batterien, weshalb es ausreichend ist, diese als Batterien zu bezeichnen. Auf den Seiten des Batterieforums Deutschland werden ausschließlich sekundäre elektrochemische Energiespeicher behandelt, weshalb hier vereinfacht oft nur von Batterien gesprochen wird, wenn sekundäre Batterien gemeint sind.
Der Begriff Batterie bedeutet streng genommen eine Zusammenschaltung (meist Serienschaltung) von mehreren Zellen. Eine Zelle ist die grundlegende, kleinste elektrochemische stromproduzierende Einheiten einer Batterie, die aus zwei Elektroden, einem Elektrolyt, dem Separator und dem Gehäuse besteht. Der Begriff Batterie wurde zunächst für alle nicht wieder aufladbaren Systeme (Primärelemente, Primärzellen) unabhängig von dem Auftreten als Einzelzelle oder Zusammenschaltung mehrerer Einzelzellen verwendet. Auch eine einzelne Zelle kann als eigenständige Batterie funktionieren. In diesem Fall können die Bezeichnung Zelle und die Bezeichnung Batterie synonym verwendet werden. Umgangssprachlich werden sekundäre Batterien noch oft mit dem veralteten Begriff Akkumulator oder kurz Akku bezeichnet.
Aufbau
Ein Sekundärelement (die kleinste als Energiespeicher funktionierende Einheit) besteht in der einfachsten Ausführung aus einer positiven und einer negativen Elektrode, einem Separator, dem Elektrolyten und einem Gehäuse.
Elektroden sind unentbehrliche Bauteile jeder elektrochemischen Zelle. Es handelt sich dabei um Materialien, die Elektronen (= elektrischen Strom) leiten. Diese sind in den meisten Fällen Festkörper, es gibt aber auch flüssige Elektroden (z. B. Quecksilber-Elektrode). In den meisten Batterietypen (etwa Lithium-Ionen-Batterien) enthalten die Elektroden die chemischen Substanzen, welche für die Energiespeicherung verantwortlich sind. Ausnahmen sind etwa Redox-Flow-Batterien.
Eine Elektrode steht in einer Zelle bzw. einer Batterie stets mit einer weiteren Elektrode (ihrer Gegenelektrode) in Wechselwirkung. Die Elektrode, die positiv geladen ist, wird als Anode bezeichnet, die andere negativ geladene als Kathode. Ist eine Batterie in Betrieb – wird sie also entladen –, fließt ein elektrischer Strom (= Elektronen) von der einen Elektrode durch einen Verbraucher (z. B. eine Glühbirne) in die Gegenelektrode. Durch den leitfähigen Elektrolyten, welcher die Elektroden umgibt, findet ein Ladungsaustausch statt, indem Ionen (geladene Atome oder Moleküle) von der einen Halbzelle in die andere wandern, um die fehlenden Ladungen der Elektronen auf der gegenüberliegenden Elektrode auszugleichen. Der Elektrolyt ist in den meisten Batterien eine Flüssigkeit, er kann aber auch ein Festkörper sein.
Die Begriffe Anode und Kathode sind streng genonmmen über den Oxidations- bzw. Reduktionsprozess (siehe Redoxreaktion) definiert, der dort stattfindet. In einer nicht wieder aufladbaren (primären) Zelle oder Batterie ist das eindeutig. An welcher Elektrode in einer sekundären Zelle oder Batterie oxidiert oder reduziert wird, hängt aber davon ab, ob die Zelle bzw. Batterie geladen oder entladen wird. Um Missverständnisse zu vermeiden, spricht man deshalb bei der Betrachtung von sekundären Batterien immer von dem Entladevorgang bei der Definition für der Begrifflichkeiten Anode und Kathode.
Der Separator hat in erster Linie die Aufgabe, Kathode und Anode in einer Zelle räumlich zu trennen und elektrisch voneinander zu isolieren, um Kurzschlüsse zu vermeiden. Damit die chemischen Reaktionen, die für die Energiespeicherung in einer Zelle verantwortlich sind, ablaufen können, muss er allerdings durchlässig für Ionen sein.
Neben diesen fundamentalen Eigenschaften, die ein Separator haben muss, kann er weitere Funktionen erfüllen. Viele Separatoren saugen beispielsweise den Elektrolyten auf, was den Vorteil hat, dass eine Batterie kompakter gebaut werden kann und der Elektrolyt bei einer Beschädigung der Batterie nicht austritt. In Lithium-Ionen-Batterien werden sogenannte Shutdown-Separatoren eingesetzt, die nicht nur als Separatoren, sondern auch als Sicherheitsbauteile fungieren. Steigt die Zelltemperatur zu stark an, schließen diese Separatoren ihre Poren und unterbrechen den Stromfluss, bevor eine Kettenreaktion ausgelöst wird, die zum Brand der Batterie führen kann.
Separatoren sind überwiegend sehr feinporige Materialien – etwa aus Kunst- oder Vliesstoffen. Welche Materialien für eine Batterie in Frage kommen, hängt von verschiedenen Faktoren ab. Sie müssen vor allem resistent gegen die Chemikalien sein, die in einer Zelle verwendet werden, aber auch preisgünstig, mechanisch belastbar und langlebig.
Funktionsweise
Die stromerzeugenden und -speichernden Reaktionen, die in Zellen bzw. Batterien ablaufen, sind chemische Reaktionen, die sogenannten Redoxreaktionen. Dies laufen immer nach dem folgenden Muster ab:
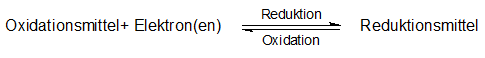 Mit jedem Oxidationsvorgang (Oxidation) ist ein Reduktionsvorgang (Reduktion) untrennbar verbunden, denn die vom reduzierten Stoff (= Reduktionsmittel) bei dessen Oxidation abgegebenen Elektronen müssen gleichzeitig von einem oxidierten Stoff (= Oxidationsmittel) aufgenommen werden, der dabei reduziert wird.
Mit jedem Oxidationsvorgang (Oxidation) ist ein Reduktionsvorgang (Reduktion) untrennbar verbunden, denn die vom reduzierten Stoff (= Reduktionsmittel) bei dessen Oxidation abgegebenen Elektronen müssen gleichzeitig von einem oxidierten Stoff (= Oxidationsmittel) aufgenommen werden, der dabei reduziert wird.
In einer Zelle oder Batterie läuft einer der beiden Vorgänge „freiwillig“ zwischen den beiden Elektroden ab, die (meist) das Oxidationsmittel und das Reduktionsmittel darstellen – und zwar sobald die darin enthaltenen Elektronen die Möglichkeit haben, von der einen Elektrode zur anderen zu fließen. Das ist der Fall, wenn ein Stromverbraucher angeschlossen wird – etwa eine Glühbirne. Fließende Elektronen bezeichnet man als elektrischen Strom. Dieser Entladeprozess dauert so lange, bis Reduktions- oder Oxidationsmittel verbraucht sind, dann ist die Zelle oder Batterie vollständig entladen.
Um die chemischen Reaktionen in der (sekundären) Batterie umzukehren, die Batterie also wieder aufzuladen, müssen die Elektronen zwischen den Elektroden in umgekehrter Richtung zum Entladen fließen. Dazu muss Energie aufgewendet werden. Diese wird in Form von elektrischem Strom zugeführt. Beim Entladeprozess werden die Elektronen also quasi „zurückgepumpt“ (vgl. Analogiemodell zur Erklärung des einfachen Stromkreises).
Da sich prinzipiell bei umgekehrter Stromrichtung viele elektrochemische Reaktionen umkehren lassen, beruht die Unterscheidung zwischen Primärelementen (nicht regenerierbar) und den regenerierbaren Sekundärelementen lediglich auf den Ausführungsformen der Zellen: Viele heute als Primärelemente klassifizierte Zellen könnten in Zukunft möglicherweise so konstruiert werden, dass sie sich auch als Sekundärelemente eignen. Wie viel Energie man hineinstecken muss oder gewinnt, wenn diese Reaktionen ablaufen, hängt von den eingesetzten Elektrodenmaterialien ab.
Erklärung mit einem Analogiemodell
Um Batterien und Begriffe wie elektrische Spannung und elektrischen Strom besser zu verstehen, kann man sich ein analoges Modell mit Wasser vorstellen: Zwei gleich große Gefäße gleicher Form sind mit Wasser gefüllt, eines aber mit mehr Wasser als das andere. Beide Gefäße sind am Boden mit einem Schlauch verbunden, der durch einen Absperrhahn verschlossen ist. Öffnet man den Hahn, fließt Wasser aus dem Gefäß, dass mit mehr Wasser gefüllt ist, so lange in das andere Gefäß, bis beide gleich hoch gefüllt sind. Der Grund ist, dass am Boden der Gefäße jeweils ein bestimmter Druck herrscht, der von der Höhe des Wasserstandes abhängt. Es fließt so lange Wasser von einem Gefäß in das andere, bis die Drücke gleich sind.
Analog kann man sich den elektrischen Stromfluss in einer Batterie vorstellen. Ist die Batterie aufgeladen, ist ein Elektronenüberschuss in der Kathode vorhanden, die elektrische Spannung ist höher als in der Anode – entsprechend dem höheren Druck in dem höher gefüllten Wassergefäß. Schließt man einen Stromabnehmer an – etwa eine Lampe – fließen so lange Elektronen (= Strom, analog dem Wasser) durch den Abnehmer in die Anode bis es keinen Unterschied zwischen den Spannungen in den Elektroden mehr besteht. Die Fließgeschwindigkeit der Elektronen von der Kathode zur Anode (vergleichbar mit der Fließgeschwindigkeit des Wassers von Gefäß zu Gefäß) entspricht der elektrischen Stromstärke.
In sekundären Batterien lässt sich dieser Entlade-Prozess umkehren, die Batterien lassen sich wieder aufladen. Dazu muss man Energie aufwenden. Beim Wassermodell ließe sich das Wasser mit einem Kolben (also mit mechanischer Arbeit) von einem Gefäß in das andere drücken. Sekundären Batterien lassen sich mit elektrischem Strom aufladen, der in umgekehrter Richtung fließt, als wenn sich die Batterie entlädt. Dabei werden die Elektronen wieder von der Anode zu Kathode „gepumpt“.
Vielfältigkeit der sekundären Batterien
Es gibt dutzende unterschiedliche Batterietypen. Und selbst unterschiedliche Vertreter eines Batterietyps wie Lithium-Ionen-Batterien haben nicht notwendigerweise die gleichen Eigenschaften. Je nach Elektrodenmaterial und weiteren unterschiedlichen Bauteilen haben diese teilweise stark voneinander abweichende Eigenschaften. So können Lithium-Ionen-Batterien mit Lithium-Eisenphosphat-Elektrode teilweise mit einer Kugel durchschossen werden, ohne dass sich die Batterie entzündet. Eine Lithium-NMC-Batterie verträgt eine derartige Behandlung nicht so gut, in ihr lässt sich aber bei gleichem Gewicht mehr Energie speichern. Um die verschiedenen Batterien zu charakterisieren, sollte man alle ihre Eigenschaften vergleichen und überlegen, welche für die vorgesehene Anwendung entscheidend sind. Dabei kann das Eigenschaftsnonagon helfen, das im Folgenden dargestellt ist.
Eigenschaftsnonagon zur Charakterisierung von sekundären Batterien
Entscheidend ist meist nicht nur, wie viel Energie pro Gewicht in einer Batterie gespeichert werden kann, also wie sie ist und wie viel Energie sie nach einer Aufladung bis zur nächsten liefert (gravimetrische Energiedichte). In der Automobilindustrie spielt es etwa eine wichtige Rolle, wie viel Bauraum die Batterien einnehmen (volumetrische Energiedichte). Diese beiden Eigenschaften sind im Nonagram unter Energiedichte zusammengefasst.
Die Leistungsdichte gibt Auskunft darüber, wie viel elektrische Leistung eine Batterie abgeben kann – also ob man damit nur einen Taschenrechner betreiben kann oder auch eine leistungshungrige Bohrmaschine, die meist nur für kurze Zeit Energie benötigt, aber dann sehr viel.
Zunehmend könnte es auch eine Rolle spielen, wie effizient sich Batterien aufladen lassen. Bei manchen Batterietypen kommt es nämlich zu relativ hohen Verlustraten, was bedeutet, dass man deutlich mehr Strom in den Ladevorgang stecken muss, als man der Batterie nachher wieder entnehmen kann. Wie viel eine Batterie kostet, wie lange sie arbeitet, bevor sie ausgetauscht werden muss, wie schnell man sie aufladen kann, und ein breiter Temperaturbereich, in dem sie reibungslos funktioniert, können ebenfalls wichtige Verkaufsargumente sein.
Aber auch die Umweltverträglichkeit der Bauteile und Sicherheitsaspekte sind nicht zu unterschätzen. Soll eine Batterie etwa in einem U-Boot eingesetzt werden, darf in keinem Fall ein Feuer ausbrechen – egal welchen extremen Bedingungen sie ausgesetzt werden kann.
Dieses Kompendium möchte einen Einblick in die unterschiedlichen Batterietypen geben und deren Vor- und Nachteile näher bringen. Die hier bisher einzeln behandelten sekundären elektrochemischen Energiespeichertypen sind mit Links in das Lexikon versehen:
- Blei-Säure-Batterien
- Metall-Ionen-Batterien
- Lithium-Ionen-Batterien
- Natrium-Ionen-Batterien
- Aluminium-Ionen-Batterien
- Magnesium-Ionen-Batterien
- Zink-Ionen-Batterien
- Redox-Flow-Batterien
- Vanadium/Vanadium, wird auch als All-Vanadium- oder Vanadium-Redox-Flow-Batterie bezeichnet
- Nickel-Batterien
- Nickel-Cadmium-Batterien
- Nickel-Metallhydrid-Batterien
- Nickel-Eisen-Batterien
- Nickel-Wasserstoff-Batterien
- Nickel-Zink-Batterien
- Thermalbatterien
- Metall-Schwefel-Batterien (nicht thermal)
- Lithium-Schwefel-Batterien
- Natrium-Schwefel-Batterien
- Magnesium-Schwefel-Batterien
- Magnesium-Sulfid-Batterien
- Metall-Luft-Batterien
- Aluminium-Luft-Batterien
- Calcium-Luft-Batterien
- Eisen-Luft-Batterien
- Lithium-Luft-Batterien
- Magnesium-Luft-Batterien
- Natrium-Luft-Batterien
- Silicium-Luft-Batterien, siehe Natrium-Luft-Batterien
- Zink-Luft-Batterien
- Dual-Ionen-Batterien
- Silber-Batterien


