sekundäre Batterie
Synonyme: Sekundärelement
veraltete Synonyme: Akkumulator (kurz: Akku)
Was landläufig als wieder aufladbare Batterie oder Akku bezeichnet wird, heißt streng genommen sekundäre Batterie oder Sekundärelement. Das ist die Bezeichnung für Vorrichtungen zur Speicherung von elektrischer Energie in Form von chemischer Energie, die als elektrische Energie entnommen werden kann. Im Gegensatz zu primären Elementen oder Batterien kann sie wieder aufgeladen werden. Dies erfolgt mit elektrischem Strom (siehe elektrischer Strom), welcher in entgegengesetzter Richtung zu dem Strom fließt, der beim Entladen entnommen wird. Das Aufladen funktioniert, weil sich die chemischen Reaktionen, die beim Entladen ablaufen, dabei nahezu vollständig rückgängig machen lassen.
Der Begriff Batterie bedeutet streng genommen eine Zusammenschaltung (meist Serienschaltung) von mehreren Zellen. Eine Zelle ist die grundlegende, kleinste elektrochemische stromproduzierende Einheiten einer Batterie, die aus zwei Elektroden, einem Elektrolyt, dem Separator und dem Gehäuse besteht. Der Begriff Batterie wurde zunächst für alle nicht wieder aufladbaren Systeme (Primärelemente, Primärzellen) unabhängig von dem Auftreten als Einzelzelle oder Zusammenschaltung mehrerer Einzelzellen verwendet. Auch eine einzelne Zelle kann als eigenständige Batterie funktionieren. In diesem Fall können die Bezeichnung Element, Zelle und die Bezeichnung Batterie synonym verwendet werden. Umgangssprachlich werden sekundäre Batterien noch oft mit dem veralteten Begriff Akkumulator oder kurz Akku bezeichnet.
Aufbau
Ein sekundäre (Batterie-)Zelle (die kleinste als Energiespeicher funktionierende Einheit) besteht in der einfachsten Ausführung aus einer positiven und einer negativen Elektrode, einem Separator, dem Elektrolyten und einem Gehäuse.
Funktionsweise
Die stromerzeugenden und -speichernden Reaktionen, die in Zellen bzw. Batterien ablaufen, sind chemische Reaktionen, die sogenannten Redoxreaktionen. Mit jedem Oxidationsvorgang (Oxidation) ist ein Reduktionsvorgang (Reduktion) untrennbar verbunden, denn die vom reduzierten Stoff (= Reduktionsmittel) bei dessen Oxidation abgegebenen Elektronen müssen gleichzeitig von einem oxidierten Stoff (= Oxidationsmittel) aufgenommen werden, der dabei reduziert wird.
In einer Zelle oder Batterie läuft einer der beiden Vorgänge „freiwillig“ zwischen den beiden Elektroden ab, die (meist) das Oxidationsmittel und das Reduktionsmittel darstellen – und zwar sobald die darin enthaltenen Elektronen die Möglichkeit haben, (als elektrischer Strom) von der einen Elektrode zur anderen zu fließen. Das ist der Fall, wenn ein Stromverbraucher angeschlossen wird – etwa eine Glühbirne. Dieser Entladeprozess dauert so lange, bis Reduktions- oder Oxidationsmittel verbraucht sind, dann ist die Zelle oder Batterie vollständig entladen.
Um die chemischen Reaktionen in der (sekundären) Batterie umzukehren, die Batterie also wieder aufzuladen, müssen die Elektronen zwischen den Elektroden in umgekehrter Richtung zum Entladen fließen. Dazu muss Energie aufgewendet werden. Diese wird in Form von elektrischem Strom zugeführt. Beim Entladeprozess werden die Elektronen also quasi „zurückgepumpt“ (vgl. Analogiemodell zur Erklärung des einfachen Stromkreises).
Da sich prinzipiell bei umgekehrter Stromrichtung viele elektrochemische Reaktionen umkehren lassen, beruht die Unterscheidung zwischen Primärelementen (nicht regenerierbar) und den regenerierbaren Sekundärelementen lediglich auf den Ausführungsformen der Zellen: Viele heute als Primärelemente klassifizierte Zellen könnten in Zukunft möglicherweise so konstruiert werden, dass sie sich auch als Sekundärelemente eignen. Wie viel Energie man hineinstecken muss oder gewinnt, wenn diese Reaktionen ablaufen, hängt von den eingesetzten Elektrodenmaterialien ab.
Vielfältigkeit der sekundären Batterien
Es gibt dutzende unterschiedliche Batterietypen. Und selbst unterschiedliche Vertreter eines Batterietyps wie Lithium-Ionen-Batterien haben nicht notwendigerweise die gleichen Eigenschaften. Je nach Elektrodenmaterial und weiteren unterschiedlichen Bauteilen haben diese teilweise stark voneinander abweichende Eigenschaften. So können Lithium-Ionen-Batterien mit Lithium-Eisenphosphat-Elektrode teilweise mit einer Kugel durchschossen werden, ohne dass sich die Batterie entzündet. Eine Lithium-NMC-Batterie verträgt eine derartige Behandlung nicht so gut, in ihr lässt sich aber bei gleichem Gewicht mehr Energie speichern. Um die verschiedenen Batterien zu charakterisieren, sollte man alle ihre Eigenschaften vergleichen und überlegen, welche für die vorgesehene Anwendung entscheidend sind. Dabei kann das Eigenschaftsnonagon helfen, das im Folgenden dargestellt ist.
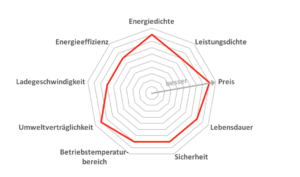
Entscheidend ist meist nicht nur, wie viel Energie pro Gewicht in einer Batterie gespeichert werden kann, also wie sie ist und wie viel Energie sie nach einer Aufladung bis zur nächsten liefert (gravimetrische Energiedichte). In der Automobilindustrie spielt es etwa eine wichtige Rolle, wie viel Bauraum die Batterien einnehmen (volumetrische Energiedichte). Diese beiden Eigenschaften sind im Nonagram unter Energiedichte zusammengefasst.
Die Leistungsdichte gibt Auskunft darüber, wie viel elektrische Leistung eine Batterie abgeben kann – also ob man damit nur einen Taschenrechner betreiben kann oder auch eine leistungshungrige Bohrmaschine, die meist nur für kurze Zeit Energie benötigt, aber dann sehr viel.
Zunehmend könnte es auch eine Rolle spielen, wie effizient sich Batterien aufladen lassen. Bei manchen Batterietypen kommt es nämlich zu relativ hohen Verlustraten, was bedeutet, dass man deutlich mehr Strom in den Ladevorgang stecken muss, als man der Batterie nachher wieder entnehmen kann. Wie viel eine Batterie kostet, wie lange sie arbeitet, bevor sie ausgetauscht werden muss, wie schnell man sie aufladen kann, und ein breiter Temperaturbereich, in dem sie reibungslos funktioniert, können ebenfalls wichtige Verkaufsargumente sein.
Aber auch die Umweltverträglichkeit der Bauteile und Sicherheitsaspekte sind nicht zu unterschätzen. Soll eine Batterie etwa in einem U-Boot eingesetzt werden, darf in keinem Fall ein Feuer ausbrechen – egal welchen extremen Bedingungen sie ausgesetzt werden kann.
Das Batterie-Kompendium gibt einen Einblick in die unterschiedlichen Batterietypen und deren Vor- und Nachteile.
Literatur
- Holze, R.; Ensinger, W., Roempp – Stichwort Akkumulatoren, Georg Thieme Verlag KG: Stuttgart (2012); Online (jüngster Zugriff: 09.01.2017)


